Fin de page
|
Fin de page |
|
| La taille de l’atome est de l’ordre du dixième
de millionième de millimètre c'est à dire
: ( 1 mm / 10 ) / 1 000 000 = 10-10 m = 0,000 000 000 1 m. Il faut imaginer 1 millimètre que l’on coupe en dix puis il faut couper en un million le petit morceau obtenu. Le nombre d’atomes d'une toute petite
parcelle d'un corps est si grand qu'il défie l'imagination
! La taille des
noyaux des atomes
est encore bien plus petite que celle de l'atome. |
Mais ce sont les chimistes des siècles plus tard, de la fin
du XVIIIème siècle et du début du XIXème siècle,
qui ont par des hypothèses (comme
Avogadro) et des travaux (comme Dalton)
établi définitivement la théorie atomique.
L'anglais John Dalton suppose alors
que l'atome est le constituant de base de toute la matière, père
incontesté de l'atome et il imagine déjà l'existence
de molécules.
Au XX ème siècle, de nombreux
chercheurs tels que Jean Perrin,
Niels Bohr, Ernest
Rutherford,
et le fameux Albert Einstein
prouvent par des expériences la structure
prévue de la matière en atomes et mettent en évidence
l'existence de noyaux et d'électrons.
Aujourd'hui, les laboratoires continuent d'étudier l'atome (son noyau, ses nucléons, leurs quarks...).
| Le modèle de l'atome a évolué, le plus courant dans les représentations des livres est le modèle de Bohr où les électrons sont sur certaines orbites bien définies. | |
| Mais dans le modèle actuel comme le pensait Louis de Broglie la position des électrons ne peut pas être définie précisément , donc on définit des zones où on a plus de chance de les trouver. | 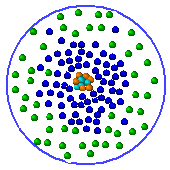 |
| Dans un corps simple, les atomes formant une molécule sont tous les mêmes. | |
| Dans un corps composé, les atomes formant une molécule sont différents. |
Ions
Dans certaines conditions, certains atomes ou groupement
d'atomes peuvent capter ou perdre un ou plusieurs électrons.
L'ensemble n'est plus neutre d'un point de vue électrique, il forme alors
ce que l'on appelle un ion.
Si c'est un seul atome qui a capté ou perdu un ou des électrons,
il devient un ion monoatomique.
Si c'est un ensemble de plusieurs atomes qui ont capté ou perdu un ou
des électrons, il devient un ion polyatomique.
Il existe des ions négatifs, les anions (gain d'électrons) et ions positifs, les cations (perte d'électrons).
Exemple : L'atome de chlore de symbole Cl peut gagner un électron
et former l'ion chlorure Cl- qui est un anion monoatomique.
Equation-bilan de formation de cet ion : Cl + 1 e- ®
Cl-
| Les ions vous les connaissez, rapellez vous en cinquième l'étiquette d'une eau minérale... |
| Exercice ions |
Pensons à la phrase d’un des premiers chimistes Antoine Laurent LAVOISIER (1743-1794 mort sur l’échafaud ) : « Rien ne se perd, rien ne se crée, tout se transforme ». Donc les atomes ne disparaissent pas et n’apparaissent pas, ils se réarrangent seulement en d'autres composés chimiques appelés produits. Mais si vous avez besoin de rappel allez faire un tour sur la page des quatrièmes.
Dans un métal, certains électrons
sont libres , ce qui permet le passage du courant
électrique.
C'est pour cela que les métaux et les alliages
sont des conducteurs de l'électricité
et de la chaleur.
Dans un métal, certaines
couches d'atomes glissent relativement facilement les unes sur les autres.
C'est pour cela que les métaux et les alliages peuvent se déformer
sans casser, ils sont dits malléables.
Les métaux sont également opaques
à la lumière et la réfléchissent.
(Penser aux miroirs argentés fabriqués avec une fine couche d'argent
posée sur une vitre).
| Les atomes dans les métaux sont arrangés régulièrement les uns contre les autres et en très grand nombre. Donc, on ne peut pas parler de "molécules" de fer ou de cuivre et on représentera un métal par le symbole de son atome. |
Tableau périodique |
|
|
|||
| Accueil | Pour aller plus loin... |